日本PDA製薬学会
注射剤不溶性異物目視検査・認定制度のご案内
日本PDA製薬学会(J-PDA) は、2025年度より、注射剤の不溶性異物目視検査の標準化を目指し、以下の認定制度を開始いたしました。
》注射剤不溶性異物目視検査 認定監督者コース
》注射剤不溶性異物目視検査 検査員の基礎能力育成コース
これらは、長年の研究成果に基づいた、標準アンプルキットを用いた実践的な制度です。
本制度設立の背景と目的
医薬品における異物対策は、品質管理の根幹です。特に注射剤の不溶性異物は、患者様の安全に関わる重要な項目です。しかし、目視検査員の検出レベルには、事業所間で差が見られる現状があります。
本制度は、標準アンプルキット を用いることで、企業や事業所間の検出力を可視化し、目視検査員および不溶性異物検査担当者の能力標準化を目指します。これにより、検査レベルのばらつきを減らし、製品の異物混入リスクを最小限に抑えることを目的としています。
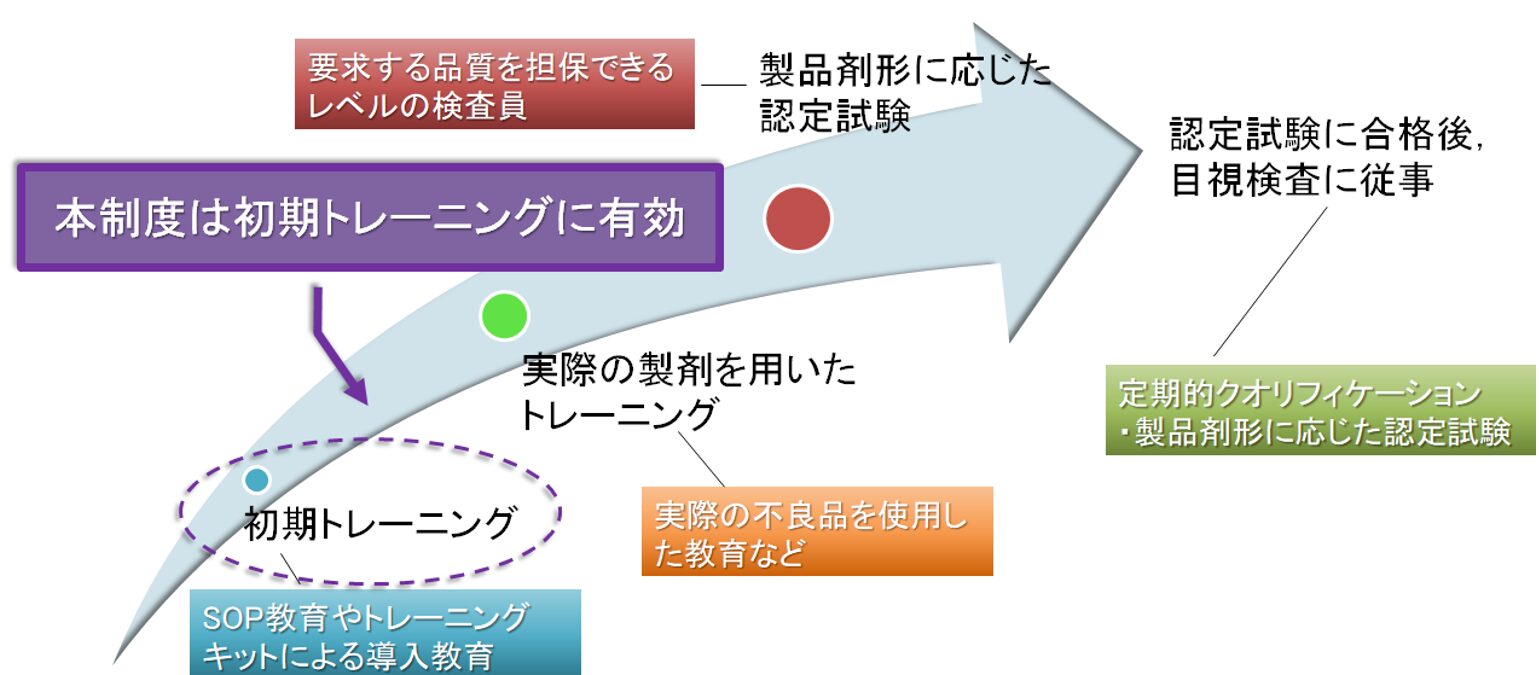
本制度の位置づけと対象者
本制度は、注射剤目視検査員や不溶性異物検査担当者の初期トレーニングに最適です。
一般的に、初期トレーニング後、剤形ごとのトレーニングや各事業所の認定試験を経て業務に従事しますが、本制度は、その初期段階における異物検知能力を共通の「標準アンプルキット」で評価するものです。
対象となる方々 は、製造部門の目視検査員だけでなく、AQL抜き取り検査や不溶性異物試験を担当する品質部門の検査担当者、さらには出荷判定に関わるQAの方々にも有用です。

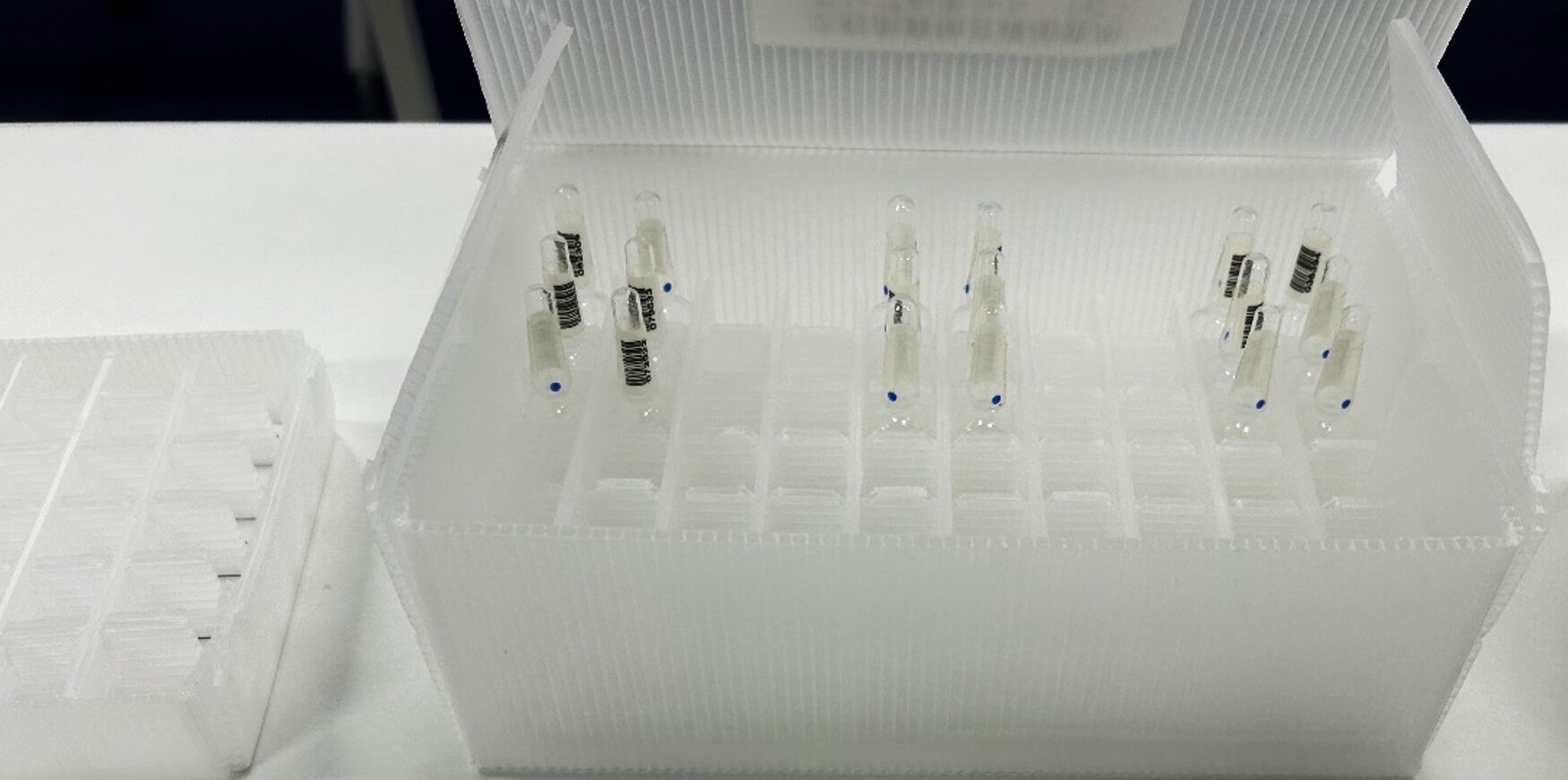
標準アンプルキットについて
本制度で使用する標準アンプルキットは、5mL規格の透明ガラスアンプルに注射用水5mLを充てんしたもので,異物無し(以下、ブランクと称す。)は54本,異物有りは,サイズごとに,ポリスチレン球入りが6本(2つの色(白・黒)×3本ずつ)あります。検査は異物の大きさごとに行い、例えばブランク54本に200μmの黒色異物3本と白色異物3本を加えたセットで行い、異物のサイズを変える場合は6本すべてを入れ替えて実施します。
当標準アンプルキットは、不良品の本数をグローバルで一般的な不良サンプルが10%以下という基準に従って設定しています。また、この標準アンプルキットを用いて2019年度に注射剤目視検査トライアルテストを協力企業(15社)に対して実施し、標準アンプルキットを用いて目視検査員および不溶性異物検査員の適格性確認が可能であること、すなわち、不溶性異物の目視検査標準化が可能であることを確認し、論文化しています1)。このように、本制度はサイエンスベースで有用性が確認された標準アンプルキットを使用して実施するものとなります。
1) PDA Journal of Pharmaceutical Science and Technology March 2025, 79 (2) 178-192
A Proof-of-Concept Study on a Universal Standard Kit to Evaluate the Risks of Inspectors for Their Foundational Ability of Visual Inspection of Injectable Drug Products
https://journal.pda.org/content/79/2/178
注射剤不溶性異物目視検査
認定監督者コース
監督者とは
「注射剤の目視検査の意味を理解し、標準アンプルキットの操作方法を検査員に正しく指導できる能力を有する者」であり、「研修の実施手順について教育を受け、認定された者」と定義します。
認定要件 は、必ずしも異物を検出できることではなく、以下の能力が求められます。
- 注射剤の異物検査に関する基礎知識
- 標準アンプルキットを用いた目視検査員適格性確認の目的を理解し、他者に説明できる能力
- 感情や態勢に流されず、冷静に業務を遂行できる能力
- SOPを構築、運用し、指導できる能力
認定の流れ

コース修了者は、監督者となります。修了者には認定証、インストラクターマニュアル、検査員教育資料などが提供されます。
有効期限:3年間 受講及び認定費(税込み):5万円
申し訳ございません。現在アンプルキット最終調整のため、検査員の試験は受け付けておりません。開始後速やかに監督者の方へご連絡をさせていただきます、どうぞよろしくお願い申し上げます。
検査員の基礎能力育成コースのお申し込みは、認定監督者が行ってください
本制度の注意点
本制度は、各企業等の検査員を認定するものではなく、基礎的な能力 が標準以上であることを評価し、成績書を発行するものです。GMP上の職員認定は、各企業・事業所にて行ってください。
「検査員/基礎能力育成コース」の修了証は、各企業・事業所のポリシーに基づいた認定にご活用ください。